Ambos isómeros tienen exactamente los mismos átomos en el mismo orden. Esto significa que las fuerzas de dispersión entre las moléculas de van der Waals serán las mismas en ambos casos. La diferencia entre los dos es que el isómero cis es una molécula polar, mientras que el isómero trans es no polar.
Los isómeros son compuestos diferentes de la misma fórmula molecular. Hay diferentes tipos de isómeros. Los isómeros se pueden dividir principalmente en dos grupos: isómeros constitucionales y estereoisómeros. Los isómeros constitucionales son isómeros en los que la conectividad de los átomos difiere en las moléculas. El butano es el alcano más simple que muestra isomería constitucional. El butano tiene dos isómeros constitucionales, el propio butano y el isobuteno.
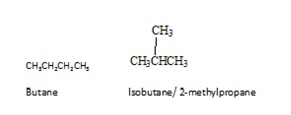
En los estereoisómeros, los átomos están conectados en la misma secuencia, a diferencia de los isómeros constitucionales. Los estereoisómeros sólo se diferencian en la disposición de sus átomos en el espacio. Los estereoisómeros pueden ser de dos tipos, enantiómeros y diastereómeros. Los diastereómeros son estereoisómeros cuyas moléculas no son imágenes reflejadas entre sí. Los isómeros cis trans del 1,2-dicloroetano son diastereómeros. Los enantiómeros son estereoisómeros cuyas moléculas son imágenes especulares no superponibles entre sí. Los enantiómeros sólo aparecen con moléculas quirales. Una molécula quiral se define como aquella que no es idéntica a su imagen especular. Por tanto, la molécula quiral y su imagen especular son enantiómeros entre sí. Por ejemplo, la molécula de 2-butanol es quiral y su imagen y su espejo son enantioméricos.
Como se mencionó anteriormente, la isomería cis trans o, en otras palabras, la isomería EZ es una forma de estereoisomería. El sistema de transcripción Cis se aplica para nombrar compuestos simples, mientras que el sistema E-Z se usa para moléculas más complicadas. Cuando una molécula tiene una rotación restringida en un sitio específico, pueden existir los isómeros cis y trans.
Cuando hay dobles enlaces carbono-carbono, hay una rotación estrecha, por lo que puede haber isómeros trans cis. En una molécula como el 1,2-dibromoeteno, dos grupos bromo pueden estar en el mismo lado del doble enlace o en el lado opuesto del doble enlace. Esto no importa si el enlace es un enlace simple, porque entonces los átomos pueden girar. Sin embargo, en este caso, dos moléculas no son iguales. Aunque los isómeros Cis y trans tienen la misma fórmula molecular y peso molecular, sus propiedades físicas son diferentes.
¿Para qué podemos usar el diodo además de la rectificación en un circuito?
¿Qué hace que un diodo PIN sea especialmente adecuado para un fotodetector?
¿Por qué los dispositivos electrónicos tienen frecuencias fijas establecidas en 50 Hz y 60 Hz?
¿En qué se diferencian los inversores de turbinas eólicas de los inversores fotovoltaicos?
