Les deux isomères possèdent exactement les mêmes atomes, dans le même ordre. Cela signifie que les forces de dispersion entre les molécules de Van der Waals seront les mêmes dans les deux cas. La différence entre les deux est que l’isomère cis est une molécule polaire, tandis que l’isomère trans est non polaire.
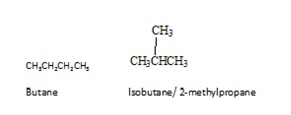
Les isomères sont différents composés de même formule moléculaire. Il existe différents types d’isomères. Les isomères peuvent être principalement divisés en deux groupes : les isomères constitutionnels et les stéréoisomères. Les isomères constitutionnels sont des isomères dans lesquels la connectivité des atomes diffère selon les molécules. Le butane est l’alcane le plus simple à présenter une isomérie constitutionnelle. Le butane possède deux isomères constitutionnels, le butane lui-même et l’isobutène.
Dans les stéréoisomères, les atomes sont connectés dans le même ordre, contrairement aux isomères constitutionnels. Les stéréoisomères diffèrent uniquement par la disposition de leurs atomes dans l’espace. Les stéréoisomères peuvent être de deux types : énantiomères et diastéréomères. Les diastéréomères sont des stéréoisomères dont les molécules ne sont pas des images réfléchies les unes des autres. Les isomères cis trans du 1,2-dichloroéthane sont des diastéréomères. Les énantiomères sont des stéréoisomères dont les molécules sont des images miroir non superposables les unes des autres. Les énantiomères n’apparaissent qu’avec des molécules chirales. Une molécule chirale est définie comme une molécule qui n’est pas identique à son image miroir. Par conséquent, la molécule chirale et son image miroir sont des énantiomères l’une de l’autre. Par exemple, la molécule 2-butanol est chirale, et son image et son miroir sont énantiomères.
Comme mentionné ci-dessus, l’isomérie cis trans ou, en d’autres termes, l’isomérie E-Z est une forme de stéréoisomérie. Le système de transcription Cis s’applique à nommer des composés simples, tandis que le système E-Z est utilisé pour des molécules plus compliquées. Lorsqu’une molécule a une rotation restreinte sur un site spécifique, les isomères cis et trans peuvent exister.
Lorsqu’il y a des doubles liaisons carbone-carbone, il y a une rotation étroite, de sorte qu’il peut y avoir des isomères trans cis. Dans une molécule telle que le 1,2-dibromoéthène, deux groupes brome peuvent se trouver du même côté de la double liaison ou du côté opposé de la double liaison. Cela n’a pas d’importance si le lien est une liaison simple, car alors les atomes peuvent tourner. Cependant, dans ce cas, deux molécules ne sont pas identiques. Bien que les isomères Cis et trans aient la même formule moléculaire et le même poids moléculaire, leurs propriétés physiques sont différentes.
A quoi peut-on utiliser une diode en dehors du redressement dans un circuit ?
Qu’est-ce qui rend une diode PIN particulièrement adaptée à un photodétecteur ?
Pourquoi les appareils électroniques ont-ils des fréquences fixes fixées à 50 Hz et 60 Hz ?
En quoi les onduleurs éoliens diffèrent-ils des onduleurs photovoltaïques ?
